精彩内容
集采及疫情冲击下,奥赛康加速创新转型,2022H1研发投入比去年同期增长21.35%,占营收比重达24.81%。2019年至今,公司有9个品种(含4个首仿)首次获批上市,20个品种过评(7个为首家/独家);聚焦创新药及高壁垒复杂制剂,奥赛康在研项目45个,13款新药(7款1类新药)在国内处于获批临床及以上阶段,首款1类新药上市可期;仿制药方面,16个新分类申报品种在审,9个暂无首仿(含剂型首仿)获批,其中有7个由奥赛康独家/首家申报。
奥赛康是国内PPI注射剂龙头企业之一,拥有6个已上市PPI注射剂中的5个。近年来,奥赛康从消化科PPI单一产品线逐年扩展至抗感染、抗肿瘤、糖尿病等治疗领域,剂型也由单一的注射剂向口服制剂延伸。
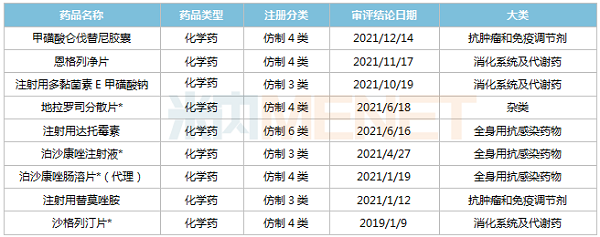
米内网数据显示,2019年至今,奥赛康有9个仿制药首次获批上市,其中有4个为首仿(含剂型首仿),包括地拉罗司分散片、泊沙康唑注射液、泊沙康唑肠溶片(独家代理)及沙格列汀片。此外,注射用替莫唑胺为第二家获批,注射用达托霉素(350mg)为独家规格。
2019年至今奥赛康获批品种
注:带*为首仿(含剂型首仿)
来源:米内网MED2.0中国药品审评数据库
地拉罗司分散片、泊沙康唑注射液、泊沙康唑肠溶片均为国家首批鼓励仿制药,其中地拉罗司是目前治疗铁过载唯一有效药物,泊沙康唑为新一代三唑类抗真菌药;沙格列汀片属于DPP4抑制剂,是奥赛康首款获批上市的口服降糖药。
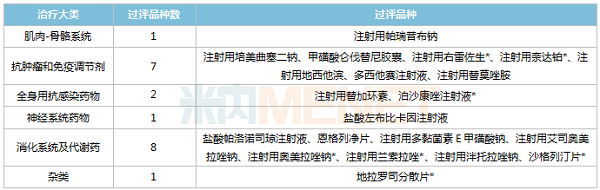
目前奥赛康已有20个品种通过或视同通过一致性评价,集中在消化系统及代谢药(8个品种)及抗肿瘤和免疫调节剂(7个品种)两大治疗领域;7个品种首家/独家过评,其中注射用右雷佐生、沙格列汀片、泊沙康唑注射液、地拉罗司分散片等为首仿+首家过评。
奥赛康已过评品种
注:带*为首家/独家过评
来源:米内网MED2.0中国药品审评数据库
奥赛康积极响应国家组织的药品集采,以实际行动切实降低患者用药负担。目前公司共有12个品种中选国家集采,其中第四批集采中选2个,第五批集采中选6个,第七批集采中选4个。
公司已过评品种中,有6个尚未纳入国家集采,其中盐酸左布比卡因注射液过评企业数已达4家,满足集采入选门槛。米内网数据显示,盐酸左布比卡因注射液在中国城市公立医院、县级公立医院、城市社区中心以及乡镇卫生院(简称中国公立医疗机构)终端的销售规模不大,且奥赛康所占市场份额也较小。
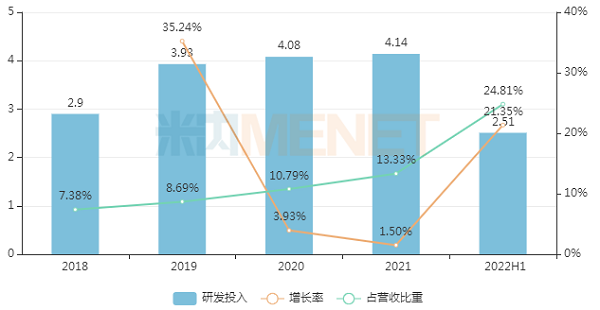
围绕消化系统、抗肿瘤、抗感染、慢性病四大领域,奥赛康持续加大研发力度,研发投入逐年递增,研发强度(研发投入占营收比重)逐渐提高。2022上半年公司研发投入2.51亿元,比去年同期增长21.35%,占营收比重达24.81%。
2018-2022H1奥赛康研发投入(单位:亿元)
来源:公司公告
奥赛康目前主要在研项目共计45项,聚焦小分子靶向创新药、肿瘤免疫领域生物创新药的研发,已经实现了定位于临床亟需、着眼于创新药、高端首仿药的研发战略转型。
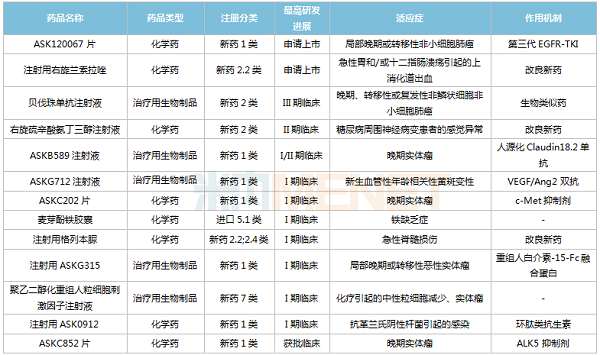
米内网数据显示,目前奥赛康在国内有13款新药(7款1类新药)处于获批临床及以上阶段,包括ASK120067片、ASKB589注射液、ASKG712注射液等1类新药,注射用右兰索拉唑、右旋硫辛酸氨丁三醇注射液、注射用格列本脲等改良型新药。
奥赛康国内在研新药
来源:米内网中国药品临床试验公示库
化学创新药方面,ASK120067片于2021年11月提交上市申请,并已完成临床现场核查和注册现场核查,有望成为公司首款获批上市的1类新药。这是一款三代EGFR-TKI,国内已获批同靶点药物包括奥希替尼、阿美替尼、伏美替尼等。近年来,以替尼类药物为主的蛋白激酶抑制剂在中国三大终端6大市场(统计范围详见本文末)的销售规模逐年上涨,2021年达388.6亿元,同比增长18.2%。
此外,处于I期临床的注射用ASK0912为环肽类抗生素,奥赛康于2019年与中国医学科学院达成技术开发协议;已获批临床的ASKC852片属于ALK5抑制剂,目前国内外暂无同靶点药物获批,国内在研品种包括劲方药业的GFH018片(II期临床)、上海璎黎药业的YL-13027片(I期临床)等。
生物创新药方面,正在开展I、II期临床的ASKB589注射液为人源化Claudin18.2单抗,通过ADCC和CDC杀伤肿瘤细胞。目前国内外暂无同靶点药物获批上市,奥赛康处于研发第一梯队;步入I期临床的注射用ASKG315属于重组人白介素-15-Fc融合蛋白,目前国内外暂无同靶点药物获批上市,国内在研新药最高进展处于II期临床;正在开展I期临床的ASKG712注射液为VEGF/Ang2双抗,公司与Affamed达成合作,目前该新药已在美国完成I期临床首例患者给药。
在仿制药方面,目前奥赛康有2个品种提交一致性评价补充申请在审,分别为注射用雷贝拉唑钠及注射用奥沙利铂,2个品种在2021年中国公立医疗机构终端的销售额分别超过15亿元、30亿元,目前均无企业过评或视同过评。
新分类申报方面,目前奥赛康有16个品种以新分类申报在审,其中9个暂无首仿(含剂型首仿)获批,苹果酸卡博替尼片、注射用德拉沙星、注射用福奈妥匹坦帕洛诺司琼等品种在国内市场空白。
奥赛康新分类申报且暂无首仿获批的品种
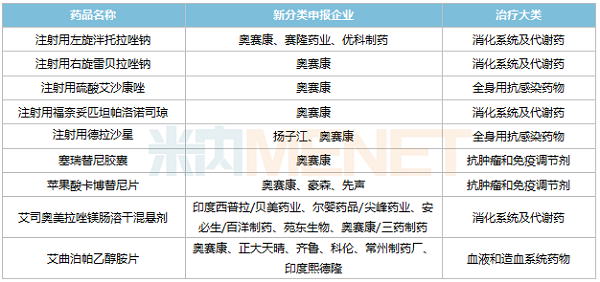
来源:米内网MED2.0中国药品审评数据库
7个品种由奥赛康独家/首家申报,其中右雷贝拉唑钠、左泮托拉唑钠分别是雷贝拉唑钠、泮托拉唑钠的优势构型,若获批上市,将有助于巩固奥赛康在PPI领域的地位。
近年来中国三大终端6大市场艾曲泊帕乙醇胺片销售情况(单位:万元)
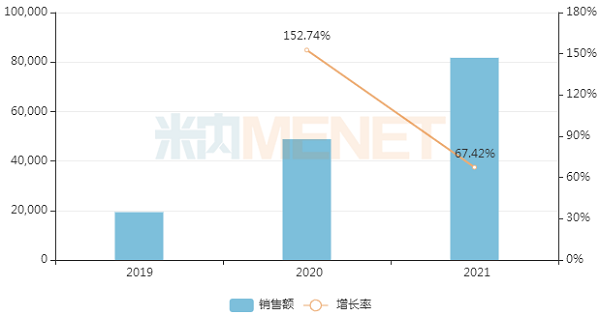
来源:米内网数据库
首仿之争最激烈的艾曲泊帕乙醇胺片是FDA批准的首个血小板减少症(ITP)口服药物,2021年全球销售额超过20亿美元,而在中国三大终端6大市场的销售额则超过8亿元,同比增长67.4%。
资料来源:米内网数据库、公司公告等
注:米内网《中国三大终端6大市场竞争格局》,统计范围是:城市公立医院和县级公立医院、城市社区中心和乡镇卫生院、城市实体药店和网上药店,不含民营医院、私人诊所、村卫生室,不含县乡村药店;上述销售额以产品在终端的平均零售价计算。数据统计截至9月26日,如有疏漏,欢迎指正!